利伐沙班专利2020年到期,价格即将雪崩
利伐沙班
CAS:366789-02-8
靶点和IC50: Factor Xa(0.7 nM),凝血酶原酶(2.1 nM)
原研公司:强生和拜耳
利伐沙班是拜耳公司和强生公司共同研发的一种高效FXa 抑制剂,用于髋或膝关节置换术后静脉血栓栓塞症(venous thromboembolism,VTE )的预防,有极好的体内活性和生物利用度。2008年10月1日分别在加拿大和欧盟获得上市批准。2009年3月获国家药监局批准上市。2011年7月1日获FDA批准,2012年1月18日获PMDA批准。利伐沙班化合物专利即将到期,价格面临雪崩。
作用机制
凝血因子 Xa是一种丝氨酸蛋白酶, 位于血液凝集级联的上游, 处在连接内源性和外源性激活途径共同通路的中心位置, 它既能阻断内源性凝血亦能抑制外源性凝血的发生。Xa因子是凝血酶生成的限速成分, 由于在血液凝集级联反应过程中还存在生物信号的放大, 估计一个 Xa因子抑制剂分子具有能抑制 138个凝血酶分子的生理效果, Xa因子抑制剂可能比凝血酶抑制剂更为有效 。本品是一个新合成的小分子, 能抑制活化的 FXa, 其浓度达到 20umol /L前并不影响相关联的丝氨酸蛋白酶, 对 FXa的选择性是其他丝氨酸蛋白酶的 10 000倍。此外, 不需血浆辅助因子的作用来完成其抗凝血过程, 不与其他丝氨酸蛋白酶作用, 因而其抗凝活性不依赖抗凝血酶 (AT )。
适应症
1.用于择期髋关节或膝关节置换手术成年患者,以预防静脉血栓形成(VTE)。 2.用于治疗成人静脉血栓形成(DVT),降低急性DVT后DVT复发和肺栓塞(PE)的风险。3.用于具有一种或多种危险因素(例如:充血性心力衰竭、高血压、年龄≥75岁、糖尿病、卒中或短暂性脑缺血发作病史)的非瓣膜性房颤成年患者,以降低卒中和全身性栓塞的风险。
规格型号
2.5mg,10mg,15mg,20mg.均为片剂。
不良反应
在三项Ⅲ期研究中评价了利伐沙班10mg的安全性,这三项研究中接受下肢骨科大手术(全髋关节置换术或全膝关节置换术)的患者共有4571例接受了最长39天的利伐沙班治疗。接受治疗的患者中,共计约14%发生了不良反应。分别有大约3.3%和1%的患者发生了出血和贫血。其它常见不良反应包括恶心、GGT升高和转氨酶升高。应该在手术背景下对不良反应做出解释。由于其药理学作用方式,利伐沙班可能会引起一些组织或器官的隐性或显性出血风险升高,可能导致出血后贫血。由于出血部位、程度或范围不同,出血的体征、症状和严重程度(包括可能的致死性结果)将有所差异。出血风险在特定患者群中可能升高,例如没有控制的重度动脉高血压患者和/或合并使用其它影响止血作用的药物的患者。出血性并发症可能表现为虚弱、无力、苍白、头晕、头痛或原因不明的肿胀。因此,在评估使用抗凝药的患者时,应考虑出血可能性。下面的表1中依照系统器官分类(MedDRA)和发生频率列出了三项Ⅲ期研究的不良反应。频率定义如下:常见:≥1/100至<1/10 少见:≥1/1,000至<1/100 罕见:≥1/10,000至<1/1,000 未知:无法根据现有数据做出估计。
禁 忌
对利伐沙班或片剂中任何辅料过敏的患者;有临床明显活动性出血的患者;具有凝血异常和临床相关出血风险的肝病患者;孕妇及哺乳期妇女禁用。
注意事项
1、出血风险:如下详述,一些亚群的患者的出血风险较高。治疗开始后,要对这些患者实施密切监测,观察是否有出血并发症征象。这可以通过定期对患者进行体格检查,对外科伤口引流液进行密切观察以及定期测定血红蛋白来实现。对于任何不明原因的血红蛋白或血压降低都应寻找出血部位。 2、肾损害:在重度肾损害(肌酐清除率<30mL/min)患者中,利伐沙班的血药浓度可能显著升高,进而导致出血风险升高。不建议将利伐沙班用于肌酐清除率<15mL/min的患者。肌酐清除率为15-29mL/min的患者应慎用利伐沙班。当合并使用可以升高利伐沙班血药浓度的其它药物时,中度肾损害(肌酐清除率30-49mL/min)患者应该慎用利伐沙班。3、肝损害:在中度肝损害(Child Pugh B类)的肝硬化患者中,利伐沙班血药浓度可能显著升高,进而导致出血风险升高。利伐沙班禁用于伴有凝血异常和临床相关出血风险的肝病患者。对于中度肝损害(Child Pugh B类)的肝硬化患者,如果不伴有凝血异常,可以谨慎使用利伐沙班。4、与其它药物的相互作用:在吡咯-抗真菌剂(例如酮康唑、伊曲康唑、伏立康唑和泊沙康唑)。请仔细阅读说明书并遵医嘱使用。
参考资料:利伐沙班说明书
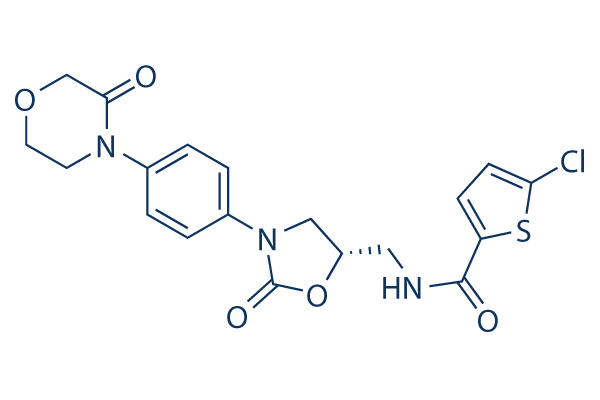
国外抗血栓药物市场情况
1.1 批准情况
1939 年,肝素钠(Heparin sodium)成为第一个获得美国食品药品监督管理局(简称 FDA)批准的抗凝血药物,如表 2 所示。1950 年 4 月,由Endo Pharms 申请 Percodan 是美国 FDA 批准的第一个阿司匹林药物。此后,美国 FDA 已批准超过90 种不同的阿司匹林药物,应用于血栓性疾病临床治疗。1987 年,由日本 Ono&Kissei 公司共同研发的奥扎格雷(Xanbao)获得日本药监局(PMDA)批准,并开始应用于临床,成为全球第一支获批上市的强力血栓合成酶抑制剂。与阿司匹林通过抑制环氧酶来阻止血小板聚集不同,奥扎格雷是通过抑制血栓素 A2合成酶和拮抗 TXA2 受体,从而产生抗血小板聚集的作用。截至 2019 年 7 月,有35 种不同的奥扎格雷药物获得日本 PMDA 批准。德国 Boehringer - Ingelheim 公司研制的双嘧达莫(Persantine)在 1961 年获得美国FDA 批准,成为全球首个环核苷酸磷酸二酯酶抑制药。CentocorInc 公司研制的阿昔单抗(Reopro)于 1993 年成为首个获得美国 FDA 批准 GP IIb/IIIa 受体拮抗剂,它既能特异性地阻断纤维蛋白原介导的血小板凝集,还具有抗凝、抑制趋化及促进平滑肌细胞凋亡的作用。1997 年,Sanofi - Aventis 公司研制的氯吡格雷药物(Plavix)是美国 FDA 唯一推荐的治疗经皮冠状动脉介入治疗稳定型冠状动脉疾病及溶栓治疗的 ST 段抬高型心肌梗死的 P2Y12 抑制剂。
1.2 全球市场情况
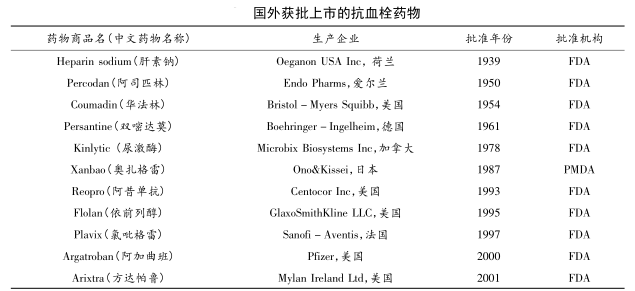
据全球畅销药物数据统计,全球销售量前五的抗血栓药物有利伐沙班、阿哌沙班、依诺肝素、氯砒格雷、替奈镨酶。2005 - 2006 年,全球抗血栓药物市场总额均保持在 100 亿美元以上,2007-2011 年抗血栓药物市场总额保持较快增长,在140 ~180 亿美元,氯噼格雷位居销售额榜首;由于 2012 年氯噼格雷等核心产品专利到期,全球抗血栓药物市场出现短暂的下滑;随着利伐沙班、达比加群酯、阿哌沙班等新药的不断上市,全球抗血栓药物市场再次呈现增长态势,2017 年市场规模达 235 亿美元,其中,拜耳/强生生产的利伐沙班片作为治疗血栓性疾病的直接凝血酶抑制剂,以 61.47 亿美元的年收入入围同年全球前十大畅销药物榜单。百时美施贵宝公司生产的阿哌沙班片销售额逐年增长,2014 年年销售额为 7.74亿美元,到 2017 年增长为 49.7 亿美元,销售额仅次于拜耳/强生生产的利伐沙班片。
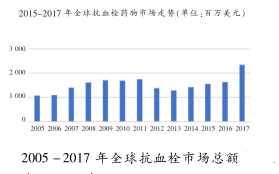

据统计数据显示,利伐沙班全球销售额分别为2009年0.27亿美元,2011年0.96亿美元,
2012年2.39亿美元,2013年21.25亿美元,2014年37.53亿美元,2015年44.86亿美元,2016年55.38亿美元,2017年61.47亿美元,2018年67.25亿美元,2019年69.07亿美元。
国内市场情况
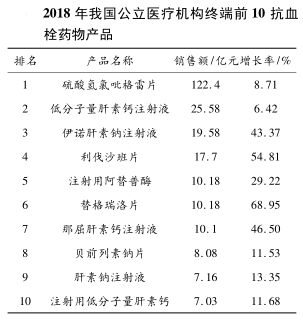
我国公立医疗机构终端抗血栓药物市场销售额自 2013 年持续保持增长态势,2018 年市场规模达到 313.58 亿元,同比 2017 年增长 19.46%。硫酸氢氯吡格雷片、低分子量肝素钙注射液、伊诺肝素钠注射液、利伐沙班片、注射用阿替普酶、替格瑞洛片、那屈肝素钙注射液、贝前列素钠片、肝素钠注射液、注射用低分子量肝素钙等抗血栓药物销售额位列前 10 名,而且在排名前7名药物的销售额均超过10 亿元,硫酸氢氯吡格雷片以122.4亿元的销售额位居首位,而替格瑞洛片以 68.95%的增速成为增长最快的抗血栓药物的市场份额。
参考资料:抗血栓药物研发和市场分析
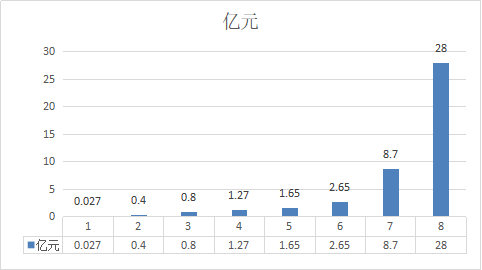
利伐沙班国内销售额分别为:2009年0.027亿元2011年0.40亿元,2012年0.8亿元,2014年1.27亿元,2015年1.65亿元,2016年2.65亿元,2017年8.7亿元,2018年28亿元。
API注册情况
已经在美国FDA注册利伐沙班原料药的企业有37家:中国8家(含台湾省1家),国外29家。
|
序号 |
类型 |
递交时间 |
持有人 |
药物成分 |
|
1 |
II |
7/23/2008 |
BAYER |
RIVAROXABAN (MICRONIZED) |
|
2 |
II |
10/21/2013 |
ZAKLADY FARMACEUTYCZNE POLPHARMA SA |
RIVAROXABAN |
|
3 |
II |
12/31/2013 |
MSN LABORATORIES PRIVATE |
RIVAROXABAN |
|
4 |
II |
3/28/2014 |
ALEMBIC PHARMACEUTICALS |
RIVAROXABAN |
|
5 |
II |
3/31/2014 |
DR REDDYS LABORATORIES |
RIVAROXABAN |
|
6 |
II |
4/10/2014 |
VIWIT PHARMACEUTICAL CO |
RIVAROXABAN ( NON-STERILE) |
|
7 |
II |
6/5/2014 |
ZHEJIANG HUAHAI PHARMACEUTICAL |
RIVAROXABAN |
|
8 |
II |
1/8/2015 |
RUYUAN HEC PHARM |
RIVAROXABAN, NON-STERILE BULK DRUG SUBSTANCE |
|
9 |
II |
1/21/2015 |
LUPIN |
RIVAROXABAN |
|
10 |
II |
11/6/2014 |
SYMED LABS |
RIVAROXABAN |
|
11 |
II |
3/6/2015 |
TARO PHARMACEUTICAL INDUSTRIES |
RIVAROXABAN MICRONIZED |
|
12 |
II |
11/30/2017 |
TEVA PHARMACEUTICAL INDUSTRIES |
RIVAROXABAN |
|
13 |
II |
1/16/2015 |
GLENMARK LIFE SCIENCES |
RIVAROXABAN |
|
14 |
II |
12/23/2014 |
MEDICHEM MANUFACTURING MALTA |
RIVAROXABAN |
|
15 |
II |
12/31/2014 |
APOTEX PHARMACHEM INC |
RIVAROXABAN |
|
16 |
II |
12/10/2014 |
MEGAFINE PHARMA P |
RIVAROXABAN (NON-STERILE DRUG SUBSTANCE) |
|
17 |
II |
1/23/2015 |
INTERQUIM SA |
RIVAROXABAN |
|
18 |
II |
2/5/2015 |
AUROBINDO PHARMA |
RIVAROXABAN |
|
19 |
II |
3/18/2015 |
RAKS PHARMA PVT |
RIVAROXABAN |
|
20 |
II |
5/18/2015 |
ZHEJIANG SUPOR PHARMACEUTICALS |
RIVAROXABAN USP |
|
21 |
II |
3/31/2016 |
PIRAMAL ENTERPRISES |
RIVAROXABAN |
|
22 |
II |
6/8/2016 |
INTAS PHARMACEUTICALS |
RIVAROXABAN FORM- I (MICRONIZED) |
|
23 |
II |
12/20/2016 |
TIANJIN WEIJIE PHARMACEUTICAL |
RIVAROXABAN |
|
24 |
II |
3/23/2017 |
JUBILANT GENERICS |
RIVAROXABAN |
|
25 |
II |
3/30/2017 |
MICRO LABS LTD |
RIVAROXABAN |
|
26 |
II |
3/16/2017 |
JIANGXI SYNERGY PHARMACEUTICAL |
RIVAROXABAN |
|
27 |
II |
7/3/2017 |
MACLEODS PHARMACEUTICALS |
RIVAROXABAN |
|
28 |
II |
7/24/2017 |
ZHEJIANG CHARIOTEER PHARMACEUTICAL |
RIVAROXABAN |
|
29 |
II |
10/2/2017 |
ZCL CHEMICALS |
RIVAROXABAN |
|
30 |
II |
1/8/2018 |
UNICHEM LABORATORIES |
RIVAROXABAN |
|
31 |
II |
5/24/2018 |
UQUIFA MEXICO SA DE CV |
RIVAROXABAN |
|
32 |
II |
2/22/2019 |
OPTIMUS DRUGS PRIVATE |
RIVAROXABAN |
|
33 |
II |
5/7/2019 |
FUXIN LONG RUI PHARMACEUTICAL |
RIVAROXABAN |
|
34 |
II |
7/6/2019 |
SRINI PHARMACEUTICALS PRIVATE |
RIVAROXABAN |
|
35 |
II |
10/15/2019 |
MYLAN LABORATORIES |
RIVAROXABAN |
|
36 |
II |
11/14/2019 |
YUNG ZIP CHEMICAL IND |
RIVAROXABAN |
|
37 |
II |
12/26/2019 |
CHANGZHOU PHARMACEUTICAL FACTORY |
RIVAROXABAN |
国家药监局网站上显示,有利伐沙班药品生产企业(包含API和制剂)53家,数量很大。
专利到期时间
化合物专利WO0147919,申请时间2000年12月11日,同族中国专利申请时间2000年12月11日。中国和加拿大最早到期,美国最晚到期。
|
国家 |
德国 |
法国 |
意大利 |
瑞士 |
西班牙 |
英国 |
|
专利到期时间 |
2023 |
2023 |
2023 |
2023 |
2023 |
2023 |
|
国家 |
中国 |
日本 |
巴西 |
加拿大 |
美国 |
|
|
专利到期时间 |
2020 |
2022-2025 特定申请专利期限延长 |
2022 |
2020 |
2024 |






